嵌合抗原受体 (chimeric antigen receptor, CAR)-T 细胞疗法在治疗血液系统恶性肿瘤方面显示出巨大的前景。尽管如此,CAR-T 细胞疗法仍然存在一些局限性。在 CAR-T 细胞生产中使用病毒导致包括插入突变导致肿瘤发展的风险增加。此外,对病毒衍生 DNA 的特定反应往往会阻碍 CAR 表达。尽管一些策略使用转座子系统和 mRNA 转导用来生成没有病毒的 CAR-T 细胞,但由于随机整合和中断 CAR 表达导致最终产物的低同质性成为额外的问题。
2022年8月31日,浙江大学黄河与华东师范大学张楫钦、刘明耀、杜冰、李大力团队合作(华东师范大学为第一单位)在Nature 杂志在线发表题为“Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL”的研究论文,该研究成功开发了一种二合一方法,通过 CRISPR-Cas9 生成非病毒、基因特异性靶向 CAR-T 细胞。通过优化将抗 CD19 CAR 盒插入 AAVS1 安全位点,在临床前研究中证明了可行性。
此外,还开发了一种整合PD1的创新型抗 CD19 CAR-T 细胞,并在异种移植模型中显示出卓越的根除肿瘤细胞的能力。在复发/难治性侵袭性 B 细胞非霍奇金淋巴瘤的过继治疗中,研究人员观察到8名患者的完全缓解率和持久反应率很高(87.5%),没有严重的不良事件。值得注意的是,这些增强的 CAR-T 细胞即使在低输注剂量和 CAR+ 细胞百分比低的情况下也是有效的。总的来说,该研究结果证明了非病毒、基因特异性整合 CAR-T 细胞的高安全性和有效性,从而为 CAR-T 细胞治疗提供了创新技术。

近年来,嵌合抗原受体(CAR)-T细胞疗法发展迅速,在癌症治疗中显示出巨大潜力。然而仍然存在一些局限性,包括复杂的制造过程、高昂的生产成本、较长的制备时间以及当前疗法的潜在安全问题。在 CAR-T 细胞生产中使用病毒会使包括插入突变导致肿瘤发展的风险增加。此外,对病毒衍生 DNA 的特定反应往往会阻碍 CAR 表达,并且病毒制造经常会产生高成本。
尽管一些策略通过使用转座子系统和 mRNA 转导正在用来生成没有病毒的 CAR-T 细胞,但由于随机整合和中断 CAR 表达导致最终产物的低同质性成为额外的问题。最近,一些研究表明,通过使用腺相关病毒 (AAV) 载体作为模板,基因组编辑技术可用于生成基因座特异性整合 CAR-T 细胞。此外,提出了一种优先的非病毒策略来生产具有点突变校正和 T 细胞受体 (TCR) 元件精确插入的 T 细胞产品。
CRISPR–Cas9介导的同源定向修复 (homology directed repair, HDR) 正在成为促进目标序列精确整合的常用方法。
为了同时解决病毒使用和随机整合的缺点,该研究通过 CRISPR-Cas9 开发了非病毒、基因特异性靶向 CAR-T 细胞,通过使用非病毒、PD1整合的抗CD19 CAR-T细胞,发现在治疗复发/难治性 B 细胞非-霍奇金淋巴瘤(r/r?B-NHL)患者具有更高的安全性,轻度细胞因子释放综合征 (cytokine release syndrome, CRS) 的发生率较低,且未发生神经毒性。这进一步证明了 CRISPR-Cas9 在 T 细胞治疗中的应用安全性。
重要的是,该研究观察到高速率和持久的细胞因子释放。特别是在两名 PD-L1 高表达的患者中发现了反应,尽管后来一名患者发生了 CD19 复发,这为PD1整合 (PD-19bbz) 细胞中PD1干扰的优势提供了支持。令人惊讶的是,尽管由于早期和仍不成熟的制造过程导致初始剂量出乎意料地低或同时低百分比的 CAR+ 细胞,但所有这三名患者都实现了细胞因子释放,这表明非病毒、靶向 PD1 的 CAR-T 细胞具有更强的杀伤肿瘤细胞的能力。
临床前和临床数据表明,PD1-19bbz 细胞对肿瘤细胞具有很高的疗效。单细胞分析表明,电穿孔法导致输液产品中记忆T细胞比例较高,PD1干扰增强了抗肿瘤免疫功能,进一步验证了非病毒、PD1整合的CAR-T细胞的优势。
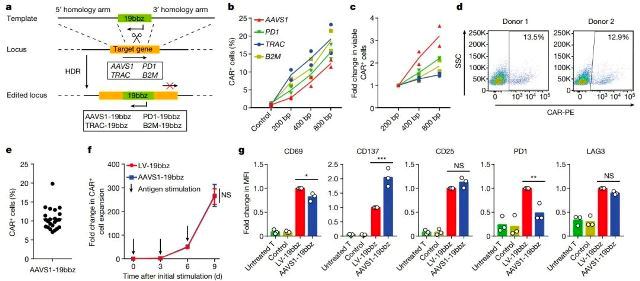
非病毒、整合AAVS1的CAR-T细胞可有效消除肿瘤细胞(图源自Nature)
总的来说,该研究描述了一种通过 CRISPR-Cas9 开发非病毒、基因特异性靶向 CAR-T 细胞的新策略。这种策略结合了非病毒制造工艺和精确基因组编辑的优势,因此是非常先进的。这也是第一个在临床试验中证明非病毒、基因特异性靶向 CAR-T 细胞的安全性和有效性的公司。
作为一种不使用病毒的二合一方法,简化了制造过程,缩短了制备时间,降低了生产成本,提高了CAR-T细胞产品的安全性和有效性。这些优势很重要,特别是对于通常需要病毒制备和基因组编辑过程的基因修饰 CAR-T 细胞的生成。此外,位点特异性整合增强了 CAR-T 细胞的同质性,使开发多功能细胞产品成为可能。
重要的是,该研究还展示了该技术从实验室到临床的可行应用,并在临床试验中证明了其高安全性和有效性。因此,这种创新的 CAR-T 技术来突破当前的障碍,并展示 CRISPR-Cas9 介导的非病毒、基因特异性靶向技术在细胞治疗中的巨大潜力。
华东师范大学生命科学学院张楫钦为论文第一作者、共同通讯作者,浙江大学医学院附属第一医院胡永仙教授、华东师范大学生命科学学院****璇硕士为本文共同第一作者。浙江大学医学院附属第一医院黄河教授为论文通讯作者,华东师范大学生命科学学院刘明耀教授、杜冰教授、李大力研究员为论文共同通讯作者。
(来源:iNature)
原文出处:Zhang J, Hu Y, Yang J, Li W, Zhang M, Wang Q, Zhang L, Wei G, Tian Y, Zhao K, Chen A, Tan B, Cui J, Li D, Li Y, Qi Y, Wang D, Wu Y, Li D, Du B, Liu M, Huang H. Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL. Nature. 2022 Aug 31. doi: 10.1038/s41586-022-05140-y. Epub ahead of print. PMID: 36045296.
链接:https://pubmed.ncbi.nlm.nih.gov/36045296/